
| termodinamica - Tubo di mariotte | ||
|---|---|---|

|
Supporto teorico | |
| La legge di Boyle - Mariotte | ||
Le legge di Boyle (1662) o legge dell'isoterma afferma che per un gas ideale a temperatura T costante il prodotto della pressione (assoluta) p per il volume V è costante, cioè in formule pV = costante (per T costante) o, il che è lo stesso, pV = p0V0 (per T costante), se con p0 e V0 si indicano rispettivamente la pressione iniziale e il volume iniziale del gas.
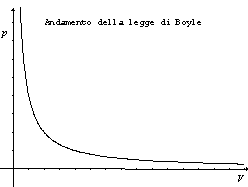 In altre parole, le relazioni precedenti esprimono che a temperatura costante (per esempio quella ambiente) dimezzando il volume a disposizione di una certa massa di gas la sua pressione raddoppia e, viceversa, raddoppiando il volume, la pressione del gas si dimezza. Ne segue che per una certa temperatura in un diagramma con il volume V del gas in ascissa e la pressione p in ordinata (piano di Clapeyron) la legge di Boyle è rappresentata da un ramo (quello positivo) di un'iperbole equilatera, come evidenziato nel diagramma qui a lato.
In altre parole, le relazioni precedenti esprimono che a temperatura costante (per esempio quella ambiente) dimezzando il volume a disposizione di una certa massa di gas la sua pressione raddoppia e, viceversa, raddoppiando il volume, la pressione del gas si dimezza. Ne segue che per una certa temperatura in un diagramma con il volume V del gas in ascissa e la pressione p in ordinata (piano di Clapeyron) la legge di Boyle è rappresentata da un ramo (quello positivo) di un'iperbole equilatera, come evidenziato nel diagramma qui a lato.
E' importante sottolineare che, dal momento che un gas ideale non esiste in natura, per i gas reali la legge di Boyle non vale sempre proprio perché il gas è reale e non ideale. Tuttavia nelle scienze applicate l'aria, per esempio, può considerarsi un gas ideale nei limiti di errore dell'1% alla temperatura ambiente e per pressioni fino a 25 atmosfere e lo stesso margine d'errore vale con pressione di una atmosfera fino a - 95 ºC. Di fatto un gas reale può essere trattato come un gas ideale quanto più si è nelle condizioni di pressione sufficientemente bassa e di temperatura alta rispetto a quella per cui si avrebbe condensazione in relazione ad un fissato valore della pressione.
Il contesto storico in cui venne formulata la legge di Boyle si colloca all'interno di quella grande serie di esperimenti che seguirono lo storico e famosissimo esperimento condotto da Evangelista Torricelli nel 1644 a seguito del quale si scoprì la pressione atmosferica e gli scienziati cominciarono ad interessarsi allo studio dell'aria e dei gas. Fu infatti nell'eseguire esperimenti di compressione di una certa massa d'aria che Boyle scoprì la legge che porta il suo nome. A titolo di curiosità si segnala che nel formulare la sua legge, Boyle non specificò che la temperatura dovesse essere mantenuta rigorosamente costante, condizione necessaria perché la relazione pV = costante sia effettivamente verificata. Egli diede infatti per scontata una tale precauzione, tuttavia il fisico francese Edme Mariotte (1620-1684), che scoprì indipendentemente la stessa legge, specificò chiaramente che la temperatura dovesse essere mantenuta costante e per questa ragione nell'Europa continentale la legge di Boyle circola spesso col nome di legge di Mariotte.