[...] Trovi nell'atomo
in generale,
un nucleo atomico
(parte centrale)
ed un involucro,
che d'ordinario
corteccia chiamasi,
o planetario.
Il nucleo atomico
di cui s'è appreso
e a cui dell'atomo
si deve il peso,
di piccolissime
parti s'avviva,
di cui la carica
è positiva
- parti che soglionsi
chiamar protoni -
e di particole
neutre: i neutroni [...]
Hanno i corpuscoli
del planetario,
invece, elettrico
segno contrario:
son quei corpuscoli
detti elettroni,
che intorno al nucleo
e ai suoi protoni
perenni girano,
come or si sa,
a un'incredibile
velocità.
[...]
da Alberto Cavaliere,
"Chimica in versi"
MURSIA, Milano,
1989, pagg. 21-22.
|
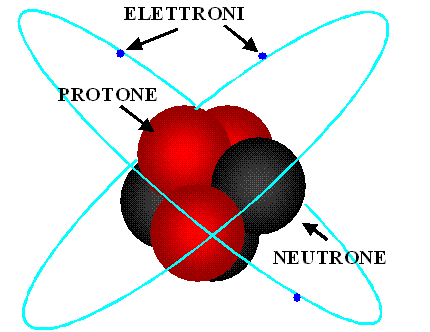 E' ormai noto che l'atomo sia tutt'altro che indivisibile; quindi esso non è l'unità fondamentale della materia. In generale in un atomo (fa eccezione l'atomo 11H, che non ha neutroni) ci sono tre particelle subatomiche: il neutrone, il protone e l'elettrone. Protoni e neutroni si trovano nel nucleo, mentre gli elettroni sono al di fuori del nucleo a "distanze" discrete da esso (orbitali).
E' ormai noto che l'atomo sia tutt'altro che indivisibile; quindi esso non è l'unità fondamentale della materia. In generale in un atomo (fa eccezione l'atomo 11H, che non ha neutroni) ci sono tre particelle subatomiche: il neutrone, il protone e l'elettrone. Protoni e neutroni si trovano nel nucleo, mentre gli elettroni sono al di fuori del nucleo a "distanze" discrete da esso (orbitali).
Il disegno qui a lato raffigura in modo davvero semplicistico un atomo. Infatti in esso di esatto vi è solamente la collocazione delle particelle subatomiche e l'evidenza che in un qualsiasi atomo neutro il numero degli elettroni è uguale a quello dei protoni nel nucleo. Tuttavia le dimensioni non sono affatto in scala e gli elettroni non si possono paragonare a delle specie di pianetini che orbitano attorno al nucleo atomico. Dunque il modello planetario dell'atomo non descrive correttamente la realtà.
Nemmeno i protoni e i neutroni sono i mattoni elementari della materia, poichè essi risultano formati da tre particelle più piccole, i quark; e qui ci si ferma... Diamo invece uno sintetico sguardo più in dettaglio a protoni, neutroni ed elettroni.
Protone
Particella del nucleo atomico con carica positiva (1,602x10-19 C), massa a riposo di 1,67265x10-27 kg (1,007276 u.m.a.), porta la più piccola carica elettrica positiva esistente libera in natura (questa particella è quindi il quanto di elettricità positiva). Il numero di protoni nel nucleo (numero atomico), stabilisce univocamente il tipo di atomo (1 protone = idrogeno, 6 protoni = carbonio, 20 protoni = calcio, ecc.).
Neutrone
E' una delle due particelle del nucleo atomico. La somma del numero di protoni e di neutroni presenti in un atomo ne dà il numero di massa. Il neutrone, scoperto nel 1932 da Chadwick, è privo di carica, con massa a riposo di 1,67500x10-27 kg (1,008665 u.m.a.). A parità di protoni, ovvero per uno stesso elemento, il numero dei neutroni può variare (isotopi). In altre parole il numero dei neutroni non è uguale a quello dei protoni, ma al crescere del numero atomico, si osserva nei nuclei in media la tendenza ad avere più neutroni dei protoni. Ciò viene spiegato dicendo che più l'atomo è pesante, maggiore è il numero di neutroni che servono per tener legati assieme i suoi protoni.
Elettrone
Particella atomica esterna al nucleo con carica negativa (-1,602x10-19 C), massa a riposo di 9,1095x10-31 kg (0,000548 u.m.a.), porta la più piccola carica elettrica negativa esistente libera in natura (questa particella è quindi il quanto di elettricità negativa). Nell'atomo neutro il numero degli elettroni è identico a quello dei protoni. Gli elettroni che occupano lo strato più esterno del guscio atomico sono responsabili del comportamento chimico (numero di legami) di ogni elemento, mentre i "salti" di uno o più elettroni da un'orbitale ad altri permettono l'identificazione univoca del tipo di atomo (Spettroscopio di Bunsen) e giustificano diversi fenomeni fisici che hanno non poche applicazioni pratiche.
 E' ormai noto che l'atomo sia tutt'altro che indivisibile; quindi esso non è l'unità fondamentale della materia. In generale in un atomo (fa eccezione l'atomo 11H, che non ha neutroni) ci sono tre particelle subatomiche: il neutrone, il protone e l'elettrone. Protoni e neutroni si trovano nel nucleo, mentre gli elettroni sono al di fuori del nucleo a "distanze" discrete da esso (orbitali).
E' ormai noto che l'atomo sia tutt'altro che indivisibile; quindi esso non è l'unità fondamentale della materia. In generale in un atomo (fa eccezione l'atomo 11H, che non ha neutroni) ci sono tre particelle subatomiche: il neutrone, il protone e l'elettrone. Protoni e neutroni si trovano nel nucleo, mentre gli elettroni sono al di fuori del nucleo a "distanze" discrete da esso (orbitali).