
Note sul copyright
Pagina Facebook
Firma anche tu il
REGISTRO VISITATORI
(GUEST BOOK)
 Note sul copyright Pagina Facebook Firma anche tu il REGISTRO VISITATORI (GUEST BOOK) | termodinamica |
|---|---|
| Supporto teorico | |
| Il calore |
Fino al 1842 (in cui fu formulato il I principio della termodinamica) energia e calore sono stati sviluppati in modo indipendente e il calore erroneamente associato al concetto di temperatura (cioè, semplificando brutalmente, alla misura di quanto è caldo o freddo un corpo). In analogia con i sistemi idraulici, in passato si ipotizzò l'esistenza del "calorico", un fluido imponderabile e indistruttibile capace di passare da un corpo all'altro. Il calorico poteva essere introdotto in un corpo o estratto da esso, ma non tutti i fenomeni osservati riuscivano ad essere spiegati in modo soddisfacente.
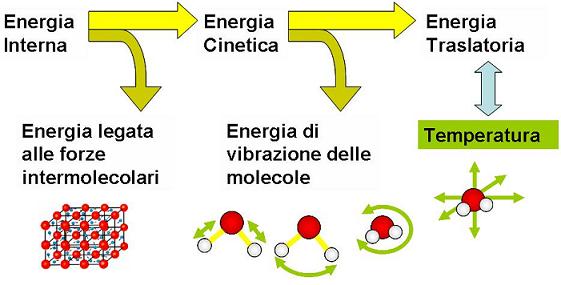 Il calore è invece una forma di energia (è energia termica) trasformabile in altre forme di energia. La temperatura e le proprietà termiche dei corpi vengono spiegate facendo riferimento al comportamento degli atomi o delle molecole che li formano (visione dal punto di vista microscopico). Salvo casi particolari, il calore è energia che passa da un corpo a un altro in conseguenza di una differenza di temperatura ΔT. Ma nel linguaggio quotidiano sono però rimaste locuzioni legate alla superata teoria del calorico. Spesso si dice “calore scambiato”, ma si dovrebbe dire in modo fisicamente più corretto “energia scambiata sotto forma di calore”.
Il calore è invece una forma di energia (è energia termica) trasformabile in altre forme di energia. La temperatura e le proprietà termiche dei corpi vengono spiegate facendo riferimento al comportamento degli atomi o delle molecole che li formano (visione dal punto di vista microscopico). Salvo casi particolari, il calore è energia che passa da un corpo a un altro in conseguenza di una differenza di temperatura ΔT. Ma nel linguaggio quotidiano sono però rimaste locuzioni legate alla superata teoria del calorico. Spesso si dice “calore scambiato”, ma si dovrebbe dire in modo fisicamente più corretto “energia scambiata sotto forma di calore”.
Il calore è dunque, per così dire, una forma di “energia in transito” che può essere definita solo mentre si trasmette. Per focalizzare meglio questo concetto importante si può ricorrere a un'analogia, quella della pioggia: la pioggia si può definire come tale solo mentre cade; finché è in cielo, è condensa in sospensione e dopo che è caduta, diventa pozzanghere o corsi d’acqua. Così, una volta trasferito, il calore o energia termica diventa parte dell’energia totale delle molecole che compongono il corpo o il sistema di corpi considerato, cioè entra a far parte dell’energia interna.
L’energia interna di un corpo è data dalla somma di tutte le energie possedute dalle sue molecole. E non tutte le energie che hanno le molecole contribuiscono direttamente a determinare la temperatura del corpo. A livello microscopico la temperatura è infatti legata al movimento traslatorio casuale delle molecole del corpo (energia cinetica di traslazione). E attenzione! Un corpo o un sistema di corpi con temperatura più alta di un altro corpo o sistema di corpi non implica automaticamente che abbia un’energia interna maggiore. L’energia interna di un sistema dipende anche dalla sua massa, ossia dal numero di molecole che lo forma.
Come energia in transito il calore lo si può misurare facendo riferimento alle quantità di energia perdute o acquistate dai corpi (calorimetria) ed è possibile utilizzare le stesse unità di misura (joule, J) impiegate per qualsiasi altra forma di energia, come per es. quella meccanica.
Storicamente c’è un’altra unità di misura del calore non del S.I., la kilocaloria. La kilocaloria è definita come la quantità di calore che si deve fornire a una massa di 1 kg di acqua alla pressione di 1 atmosfera per elevarne la temperatura di 1 ºC da 14,5 ºC a 15,5 ºC. Simbolo: kcal. Se anziché 1 kg di acqua si considera 1 g di acqua, allora si ha la caloria, pari a 1/1000 di kilocaloria. Simbolo: cal.
Molti scienziati studiarono il rapporto tra calore ed energia. Nel 1849 James P. Joule determinò l’equivalente meccanico del calore con il famoso esperimento del mulinello. L’acqua aumenta di temperatura come se si fosse introdotto in modo fittizio del calore; è invece introdotta energia meccanica, misurabile in termini di aumento di temperatura (per es. di 1 ºC di 1 kg d’acqua). Per mezzo di tale esperimento Joule determinò un valore dell'equivalente meccanico del calore pari a 4186 J/kcal, valore di straordinaria precisione per quei tempi. Quindi: 1 kcal = 4186 J o anche 1 cal = 4,186 J.
| La riproduzione totale o parziale di questa pagina e/o di sue parti con qualsiasi mezzo è consentita solo se è senza fini di lucro e sempre con la citazione ben visibile su tutti gli oggetti del nome o dei nomi degli autori e del Liceo Marco Foscarini. Per quanto riguarda i lavori ipertestuali, alle citazioni e/o alle fotografie va sempre aggiunto un link verso la pagina o le pagine del Museo Virtuale o del Museo di Fisica A. M. Traversi utilizzate come fonte. Non copiare totalmente una pagina (testo con o senza foto) o lunghe sezioni; si utilizzino invece link verso le pagine di interesse. La riproduzione di qualsiasi fotografia prelevata da questa pagina in riviste scientifiche e/o in elaborati prodotti nell'ambito di progetti di ricerca necessita del permesso da parte della Direzione del Museo Traversi. Tale permesso, di esclusiva pertinenza della Direzione del Museo, viene eventualmente rilasciato dopo presentazione di un'apposita domanda (si consulti al riguardo la voce Ricerca del sito internet del Museo Traversi). Per altre informazioni si consultino le note in materia di copyright. Tutte le informazioni di carattere tecnico legate agli strumenti descritti nel Museo Virtuale sono oggetto di continuo aggiornamento. Sono pertanto possibili non corrispondenze tra pagina in rete e ultimi dati raccolti; gli interessati sono pregati di contattare la Direzione del Museo. | ||
| URL del Museo Virtuale: http://museo.liceofoscarini.it/virtuale/index.html URL del Museo di Fisica "A. M. Traversi": http://museo.liceofoscarini.it; e-mail: museo.atraversi@del@liceofoscarini.it [Rimuovere "del@" per avere l'indirizzo corretto]. |
| Liceo Classico "Marco Foscarini" - Venezia | ||||