

| Termodinamica |
|---|---|
| Supporto teorico | |
| La capacità termica e il calore specifico |
 Evidenza sperimentale: a parità di calore Q fornito a masse uguali di sostanze diverse, la variazione di temperatura ΔT che ne risulta non è in genere uguale.
Evidenza sperimentale: a parità di calore Q fornito a masse uguali di sostanze diverse, la variazione di temperatura ΔT che ne risulta non è in genere uguale.
Rispetto all'alluminio, nell’acqua una frazione maggiore dell'energia termica fornita Q va a finire nella porzione non cinetica dell'energia interna. Le sostanze differiscono per configurazione e legami chimici è ΔT in genere diversi.
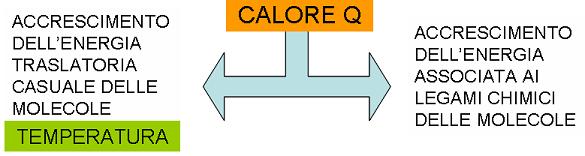 Fornendo calore a un corpo, esso si scalda, ovvero si porta ad una temperatura più alta di quella prima del riscaldamento. La quantità di calore Q richiesta per cambiare la temperatura di una data sostanza è direttamente proporzionale alla massa m della sostanza stessa e alla variazione di temperatura ΔT, cioè Q = cmΔT.
Fornendo calore a un corpo, esso si scalda, ovvero si porta ad una temperatura più alta di quella prima del riscaldamento. La quantità di calore Q richiesta per cambiare la temperatura di una data sostanza è direttamente proporzionale alla massa m della sostanza stessa e alla variazione di temperatura ΔT, cioè Q = cmΔT.
Calore specifico
Nella relazione Q = mcΔT c è una costante caratteristica, cioè specifica di una data sostanza, essendo connessa alla sua struttura e ai suoi legami chimici, e viene chiamata calore specifico. Attenzione (Apparecchio di Tyndall): c non va confusa con la temperatura!! Il suo valore indica la quantità di energia (calore) che è necessario fornire a 1 kg di sostanza (cioè all'unità di massa di una certa sostanza) per elevarne la temperatura di 1 ºC. Ne segue che a parità di ΔT, una sostanza con elevato c assorbe o cede una maggiore quantità di calore.
Il calore specifico varia con la temperatura, tuttavia in molte applicazioni pratiche, essendo la variazione molto piccola, è comunemente assunto costante, naturalmente se si ha un intervallo non molto ampio di variazione della temperatura. Il calore specifico c di una sostanza viene determinato sperimentalmente in base alla misura di altre grandezze che figurano nella relazione Q = mcΔT. Il ramo della termodinamica che si occupa di tali misurazioni è la calorimetria; un classico strumento è il calorimetro.
Capacità termica
Per i corpi omegenei il prodotto tra massa m e calore specifico c dà la capacità termica C del corpo, ovvero C = cm. Dalla relazione Q = mcΔT segue evidentemente che la capacità termica di una sostanza è definta come la quantità di calore necessaria per elevare di 1 ºC la temperatura dell'intero corpo.