
REGISTRO VISITATORI
| TA KIMIKA - Sezione pH | |
|---|---|
 REGISTRO VISITATORI |
Approfondimenti |
| Concetto di equilibrio dinamico | |
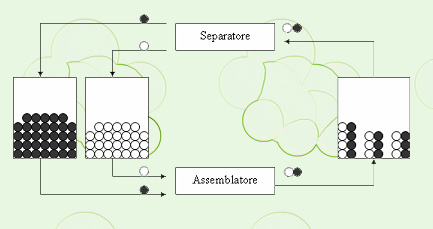 La parola equilibrio è un concetto tutto sommato familiare, ma in abito chimico il suo significato ha una connotazione dinamica, non statica. In questa pagina si cercherà di chiarire quanto affermato.
La parola equilibrio è un concetto tutto sommato familiare, ma in abito chimico il suo significato ha una connotazione dinamica, non statica. In questa pagina si cercherà di chiarire quanto affermato.
Si consideri il sistema schematizzato nel disegno. Si hanno tre contenitori: uno con palline bianche, uno con palline nere e uno che ospita l'oggetto realizzato unendo una pallina bianca con una nera. Ciascun contenitore è munito di un sistema che permette di sapere in ogni istante il numero di oggetti in esso contenuto. Una persona, detta "assemblatore", ha il compito di prendere dal rispettivo contenitore una pallina per tipo, di unirle e di mettere l'oggetto ottenuto nel terzo contenitore. Un'altra persona, detta "separatore", ha invece il compito opposto, cioè prendere le palline unite, smontarle e mettere ognuna di esse nel rispettivo contenitore.
A livello macroscopico si può pensare che un osservatore sia solo in grado di notare il variare nel tempo dei contatori presenti sui contenitori, ma non di vedere fisicamente né le palline che si riuiscono, né quelle che vengono separate, così come nella realtà gli atomi non si vedono reagire tra di loro. Ora, se la velocità dell'"assemblatore" è maggiore di quella del "separatore", il numero di oggetti costituiti da due palline riunite crescerà nel tempo e parimenti il numero delle biglie in ciascun contenitore tenderà a calare. L'osservatore noterà questa evoluzione del sistema attraverso l'andamento dei contatori. Viceversa, se la velocità dell'"assemblatore" è minore di quella del "separatore", il numero di oggetti costituiti da due palline riunite diminuirà nel tempo e invece il numero delle biglie in ciascun contenitore tenderà a crescere.
Ma come interpretare l'eventuale situazione di costanza dei valori su tutti i contatori? O con l'assenza di ogni processo sulle biglie oppure che le velocità di "assemblatore" è "separatore" sono identiche. Nel contesto dell'equilibrio chimico l'interpretazione corretta è la seconda. Macroscopicamente si nota una situazione di stasi, di equilibrio appunto, relativamentee alle grandezze significative capaci di descrivere compiutamente il sistema (di solito le pressioni parziali oppure le concentrazioni molari), ma microscopicamente gli atomi non sono fermi, ma restano sempre coinvolti in reazioni chimiche, una l'opposto dell'altra, che continuano ad avvenire, così come si vedrebbero le biglie transitare tra le mani dell'"assemblatore" è del "separatore", pur rimanendo costante il numero di oggetti presenti in ciascun contenitore. Per questo motivo l'equilibrio è detto, appunto, dinamico.
Classico esempio è la reazione reversibile
Non appena ha luogo in un contenitore con una certa velocità v1 la reazione di sintesi H2 + I2 => 2HI, l'acido iodidrico (o idrogeno ioduro) tende a dissociarsi con una velocità v2 secondo la reazione opposta alla precedente H2 + I2 <= 2HI. A un certo punto, dipendente dalle condizioni al contorno (temperatura, pressione, somministrazione di calore al sistema), quando le velocità v1 e v2 si equivalgono, si raggiunge una condizione di equilibrio, visto che la reazione di sintesi procede con la stessa velocità di quella di decomposizione. Globalmente (ovvero da un punto di vista macroscopico) non varia più nulla nel sistema, ma questo non vuol dire che non abbiano più luogo le due reazioni opposte, tutt'altro: esse avvengono sempre, solo che hanno la stessa velocità.
Vedendo le cose microscopicamente, all'equilibrio gli atomi non sono "fermi", ma per esempio per due atomi di idrogeno (reagenti) che passano dall'elemento in due nuove molecole d'acido iodidrico (prodotti) contemporaneamente (cioè con la stessa velocità) altre due molecole di HI (reagenti) si dissociano per ridare due atomi di idrogeno che vanno ad unirsi e a formare una nuova molecola di H2 (prodotti). Tutto questo si rappresenta scrivendo la reazione chimica con una doppia freccia, in modo da indicare che la reazione è reversibile.
| Ultimo aggiornamento il 20-7-2023 | Quelli in verde sono link non ancora attivati. |
| Liceo Classico "Marco Foscarini" - Venezia | ||
|---|---|---|
| Museo di Fisica Traversi | Presentazione della scuola | Indirizzi, Numeri di telefono, E-Mail |