 La pila di Volta venne ben presto disposta diversamente. Infatti essa presenta l'inconveniente che le rotelle di stoffa, compresse dal peso dei dischi sovrastanti, lasciano fuoriuscire il liquido di cui sono inzuppate. Questo fatto provoca il malfunzionamento della pila per cortocircuito di un certo numero di elementi. In altre parole, la fuoriuscita del liquido, a causa della particolare disposizione dei dischi del dispositivo, fa ridurre la forza elettromotrice (fem) complessiva ottenuta sommando quelle di tutti i singoli elementi collegati in serie.
La pila di Volta venne ben presto disposta diversamente. Infatti essa presenta l'inconveniente che le rotelle di stoffa, compresse dal peso dei dischi sovrastanti, lasciano fuoriuscire il liquido di cui sono inzuppate. Questo fatto provoca il malfunzionamento della pila per cortocircuito di un certo numero di elementi. In altre parole, la fuoriuscita del liquido, a causa della particolare disposizione dei dischi del dispositivo, fa ridurre la forza elettromotrice (fem) complessiva ottenuta sommando quelle di tutti i singoli elementi collegati in serie.
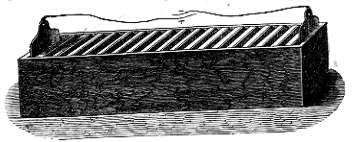
Perciņ, per evitare l'inconveniente appena descritto, fu adottata la pila cosiddetta "a trogoli" (vedi figura). Rispetto alla pila a colonna, la modifica apportata è evidente, dal momento che la pila a trogoli non è altro che una pila di volta classica disposta però orizzontalmente. Infatti questo tipo di pila presenta una cassa rettangolare di legno intonacata internamente con un mastice isolante entro cui le lastre di zinco e di rame, saldate tra loro a due a due, formano delle coppie che hanno una grandezza uguale alla sezione interna della cassa. Esse sono poi fissate nel mastice in modo che fra una coppia e l'altra vi sia un piccolo intervallo cosicché ne risultino altrettanti compartimenti o trogoli appunto. In questi ultimi si versa una soluzione acquosa diluita di acido solforico la cui funzione è la stessa delle rotelle inzuppate presenti nella pila a colonna.
Per quanto detto, è evidente che la schematizzazione IUPAC della pila a trogoli è la stessa della pila a colonna, cioè: Zn | H2SO4 (aq., dil.) | Cu. Infatti la lamina di zinco di ciascun elemento costituisce il polo negativo, mentre la lamina di rame è il polo positivo. La soluzione diluita di acido solforico, ovvero il conduttore di seconda classe, diminuisce di concentrazione con il funzinamento, dal momento che al catodo si forma idrogeno secondo la semireazione di riduzione 2H+ + 2e- => H2 (con le soluzioni saline gli ioni H+ vengono ottenuti dall'acqua). Quindi l'elettrodo di rame è inerte.
 La pila di Volta venne ben presto disposta diversamente. Infatti essa presenta l'inconveniente che le rotelle di stoffa, compresse dal peso dei dischi sovrastanti, lasciano fuoriuscire il liquido di cui sono inzuppate. Questo fatto provoca il malfunzionamento della pila per cortocircuito di un certo numero di elementi. In altre parole, la fuoriuscita del liquido, a causa della particolare disposizione dei dischi del dispositivo, fa ridurre la forza elettromotrice (fem) complessiva ottenuta sommando quelle di tutti i singoli elementi collegati in serie.
La pila di Volta venne ben presto disposta diversamente. Infatti essa presenta l'inconveniente che le rotelle di stoffa, compresse dal peso dei dischi sovrastanti, lasciano fuoriuscire il liquido di cui sono inzuppate. Questo fatto provoca il malfunzionamento della pila per cortocircuito di un certo numero di elementi. In altre parole, la fuoriuscita del liquido, a causa della particolare disposizione dei dischi del dispositivo, fa ridurre la forza elettromotrice (fem) complessiva ottenuta sommando quelle di tutti i singoli elementi collegati in serie.