
Note sul copyright
Pagina Facebook
Firma anche tu il
REGISTRO VISITATORI
(GUEST BOOK)
 Note sul copyright Pagina Facebook Firma anche tu il REGISTRO VISITATORI (GUEST BOOK) |
elettrochimica - nozioni d'elettrochimica |
|---|---|
| Nozioni d'elettrochimica | |
| L'elettrodo normale a idrogeno | |
| Precedente - PAGINA - Successiva |
Per esprimere quantitativamente la tendenza di un metallo a passare in soluzione, cioè il suo potenziale assoluto d'elettrodo, è necessario trovare un metodo per misurarlo. Solo in questo modo si può dare significato quantitativo all'affermazione spiccatamente qualitativa che una pila funzione perché, unendo due semicelle diverse, una delle due ha una maggior "forza" dell'altra in relazione al processo di dissoluzione.
Per far ciò osserviamo per prima cosa che la differenza di potenziale ai capi delle due lamine di metallo, una per semicella, che costituiscono una semplice pila (si trascurano per semplicità le soluzioni più complesse), si ottiene facilmente in via di principio per semplice differenza tra i potenziali assoluti d'elettrodo. In altre parole, in una pila formata da una semicella con il rame di potenziale assoluto d'elettrodo Y e da un'altra con lo zinco con potenziale assoluto pari a X, la differenza di potenziale della pila è semplicemente Y - X. Da ciò si ricava poi che in via del tutto generale conoscendo in qualche modo i valori X e Y per una qualsiasi semireazione, si potrebbe calcolare facilmente la differenza di potenziale tra gli elettrodi della pila che sfrutta le due semireazioni scelte.
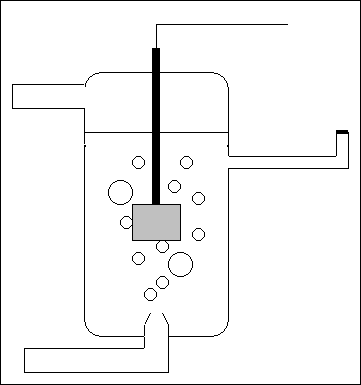
Purtroppo le cose non sono così semplici, dal momento che è difficilissimo calcolare il valore del potenziale assoluto d'elettrodo di un semicella. Inoltre per via sperimentale la sua misura richiederebbe obbligatoriamente un secondo elettrodo direttamente o indirettamente a contatto con la soluzione della semicella. Ciò comporta la formazione di un altro micro condensatore a livello del secondo elettrodo e di fatto alla formazione di una pila completa. Insomma in questo modo ciò che si misurerebbe sarebbe sempre una differenza di potenziale tra due metalli, ovvero di una pila, e non quella solo della semicella in esame. Si deve poi considerare che il potenziale assoluto d'elettrodo varia con la concentrazione della soluzione elettrolitica e anche con la temperatura.
Visto che è impossibile eliminare il secondo elettrodo per eseguirte la misura, è stato allora introdotto l'elettrodo normale a idrogeno, cioè un particolare elettrodo di riferimento. Di questo elettrodo, meglio semicella, sono state rigorosamente definite le condizioni da realizzare per ottenere il valore convenzionale nullo del suo potenziale. Esso è formato da un elettrodo di platino platinato (in grigio), immerso in una soluzione acquosa acida 1 molare nella quale viene fatto gorgogliare idrogeno gassoso puro, mantenuto alla pressione di una atmosfera. Il platino, oltre a servire come conduttore attraverso cui gli elettroni possono entrare ed uscire dall'elettrodo, agisce anche come catalizzatore ed essendo poroso, in seguito al trattamento elettrochimico eseguito sulla sua superficie, le molecole di idrogeno vengono adsorbite e costituiscono l'elettrodo vero e proprio. Sempre per convenzione all'elettrodo standard ad idrogeno viene assegnato potenziale nullo a tutte le temperature.
In queste condizioni, l'equilibrio elettrochimico che si instaura abbastanza rapidamente è espresso dalla reazione d'ossidoriduzione semplificata 2H+ + 2e- <=> H2. Per la verità, dal momento che il tutto avviene in soluzione acquosa e che nella realtà un protone (H+) non può partecipare così come sta ad una reazione chimica per questioni energetiche, la reazione corretta sarebbe 2H3O+ + 2e- <=> H2 + 2H2O.
| La riproduzione totale o parziale di questa pagina e/o di sue parti con qualsiasi mezzo è consentita solo se è senza fini di lucro e sempre con la citazione ben visibile su tutti gli oggetti del nome o dei nomi degli autori e del Liceo Marco Foscarini. Per quanto riguarda i lavori ipertestuali, alle citazioni e/o alle fotografie va sempre aggiunto un link verso la pagina o le pagine del Museo Virtuale o del Museo di Fisica A. M. Traversi utilizzate come fonte. Non copiare totalmente una pagina (testo con o senza foto) o lunghe sezioni; si utilizzino invece link verso le pagine di interesse. La riproduzione di qualsiasi fotografia prelevata da questa pagina in riviste scientifiche e/o in elaborati prodotti nell'ambito di progetti di ricerca necessita del permesso da parte della Direzione del Museo Traversi. Tale permesso, di esclusiva pertinenza della Direzione del Museo, viene eventualmente rilasciato dopo presentazione di un'apposita domanda (si consulti al riguardo la voce Ricerca del sito internet del Museo Traversi). Per altre informazioni si consultino le note in materia di copyright. Tutte le informazioni di carattere tecnico legate agli strumenti descritti nel Museo Virtuale sono oggetto di continuo aggiornamento. Sono pertanto possibili non corrispondenze tra pagina in rete e ultimi dati raccolti; gli interessati sono pregati di contattare la Direzione del Museo. | ||
| URL del Museo Virtuale: http://museo.liceofoscarini.it/virtuale/index.html URL del Museo di Fisica "A. M. Traversi": http://museo.liceofoscarini.it; e-mail: museo.atraversi@del@liceofoscarini.it [Rimuovere "del@" per avere l'indirizzo corretto]. |
| Liceo Classico "Marco Foscarini" - Venezia | ||||