
| Elettrochimica - Richiami | |
|---|---|

|
Nozioni d'elettrochimica |
| Richiami introduttivi | |
| Spontaneità e non spontaneità | |
| Precedente - Pagina - Successiva | |
Spontaneità e non spontaneità di un processo sono concetti molto comuni e in un certo senso quasi familiari, perché coinvolgono di continuo la nostra esperienza giornaliera in relazione ad un gran numero di fenomeni, non necessariamente tutti di tipo chimico. L'acqua che scende a valle formando una o più cascate spettacolari è un tipico esempio di fenomeno spontaneo, mentre il sollevamento di una certa quantità d'acqua fino ai piani alti di un grattacielo è invece un processo non spontaneo, tant'è che si impiega una pompa. Questa suddivisione ha un'enorme importanza sia in natura che in tantissimi rami delle scienze applicate.
Dal punto di vista chimico il motivo principale che giustifica il verificarsi "naturale" delle reazioni chimiche nel loro insieme sono questioni di natura energetica che si concretizzano, quando ciò è possibile, nell'evoluzione del sistema verso più favorevoli (ovvero più bassi) valori di energia dei prodotti rispetto a quella posseduta dai reagenti. Nelle redox questa differenza di energia entra in gioco come energia elettrica.
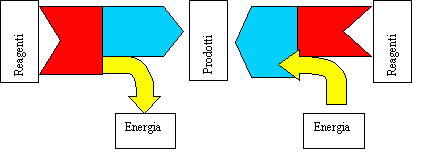 Considerando il diagramma di sinistra in figura in una reazione redox spontanea parte dell'energia posseduta dai reagenti viene convertita in energia elettrica (che, con qualche perdita, può essere utilizzata per compiere lavoro), mentre la parte restante resta "congelata" nei prodotti. Ciò è quanto avviene nelle pile: infatti ogni pila fornisce energia elettrica attraverso una conversione elettrochimica.
Considerando il diagramma di sinistra in figura in una reazione redox spontanea parte dell'energia posseduta dai reagenti viene convertita in energia elettrica (che, con qualche perdita, può essere utilizzata per compiere lavoro), mentre la parte restante resta "congelata" nei prodotti. Ciò è quanto avviene nelle pile: infatti ogni pila fornisce energia elettrica attraverso una conversione elettrochimica.
Invece in un processo redox non spontaneo si innalza l'energia chimica dei prodotti rispetto a quella posseduta dai reagenti e ovviamente tale differenza deve essere fornita al sistema dall'esterno (ad esempio sotto forma di corrente elettrica nel caso di un processo di elettrólisi). In altre parole, per far avvenire una reazione di ossidoriduzione non spontanea bisogna fornire al sistema energia dall'esterno. Quanto appena detto è illustrato graficamente in figura dal disegno di destra.