

|
elettrochimica - nozioni d'elettrochimica |
|---|---|
| Nozioni d'elettrochimica | |
| Elettrolisi dell'acqua | |
| Precedente - PAGINA - Indice |
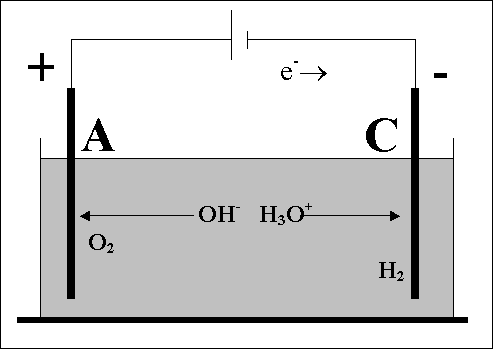 L'elettrolisi dell'acqua avviene in una cella elettrolitica come quella schematizzata qui a lato. L'acqua pura, benché sia poco dissociata, pur tuttavia contiene ioni H3O+ e OH- in concentrazioni per ciascuna specie pari a 10-7 moli/litro. Si ha quindi che al passaggio di corrente elettrica gli ioni H3O+ migrano verso il catodo (C), ove avviene la semireazione di riduzione
2H3O+ + 2e- => 2H2O + H2,
mentre gli anioni OH- si muovono verso l'anodo (A), dove ha luogo la semireazione di ossidazione
4OH- => 4e- + 2H2O + O2. In definitiva, bilanciando gli elettroni nelle due semireazioni, la reazione d'ossidoriduzione che si realizza nella cella elettrolitica in cui ha luogo l'elettrolisi dell'acqua è
2H2O => 2H2 + O2.
L'elettrolisi dell'acqua avviene in una cella elettrolitica come quella schematizzata qui a lato. L'acqua pura, benché sia poco dissociata, pur tuttavia contiene ioni H3O+ e OH- in concentrazioni per ciascuna specie pari a 10-7 moli/litro. Si ha quindi che al passaggio di corrente elettrica gli ioni H3O+ migrano verso il catodo (C), ove avviene la semireazione di riduzione
2H3O+ + 2e- => 2H2O + H2,
mentre gli anioni OH- si muovono verso l'anodo (A), dove ha luogo la semireazione di ossidazione
4OH- => 4e- + 2H2O + O2. In definitiva, bilanciando gli elettroni nelle due semireazioni, la reazione d'ossidoriduzione che si realizza nella cella elettrolitica in cui ha luogo l'elettrolisi dell'acqua è
2H2O => 2H2 + O2.
Si può dimostrare che la tensione teorica minima da applicare ad una cella elettrolitica con elettrodi inerti di platino platinato è di 1,23 V. Tuttavia a causa di tutta una serie di fenomeni, nella realtà la differenza di potenziale richiesta risulta essere più elevata. Inoltre, data la scarsa conducibilità elettrica dell'acqua pura, l'elettrolisi deve essere effettuata in presenza di opportuni elettroliti in essa disciolti al fine di aumentare la conducibilità della soluzione. Del resto, per ovviare alla bassa conduzione elettrolitica dell'acqua, già la prima volta che fu effettuata l'elettrolisi dell'acqua, ad opera dei due scienziati inglesi Carlisle e Nicholson (era il 1800), essi sottoposero al processo di lisi una soluzione acquosa leggermente acidula aggiungendo semplicemente qualche goccia di acido solforico.
Questo "trucco" è utilizzato ancor'oggi per far riuscire qualitativamente e quantitativamente (Voltametri) la scissione per via elettrica dell'acqua in tempi ragionevoli, a patto però che si sappia quali acidi aggiungere o eventualmente quali sali sciogliere nell'acqua distillata, poiché non tutti questi composti vanno bene per ottenere un buon risultato e/o i prodotti desiderati (Apparecchio per la scomposizione dei sali). I composti da aggiungere all'acqua possono essere un acido, una base o un sale, ma per non rovinare gli elettrodi e/o avere prodotti indesiderati bisogna essere in grado di prevedere l'ordine di scarica agli elettrodi scegliendo questi composti con criterio e precisamente avendo cura che:
Sotto queste condizioni l'elettrolisi dell'acqua avviene con notevole sviluppo di idrogeno e di ossigeno già operando con tensioni di circa 1,8 V (3 V con elettrodi al carbone).