

|
elettrochimica - nozioni d'elettrochimica |
|---|---|
| Nozioni d'elettrochimica | |
| Cenni sull'equazione di Nernst | |
| Precedente - PAGINA - Successiva |

I potenziali standard di riduzione possono essere confrontati tra loro perché fanno capo allo stesso elettrodo di riferimento (l'elettrodo normale a idrogeno, lo zero della scala) e risultano poi coerenti tra di loro per costruzione, essendo riferiti a sistemi nelle stesse condizioni di temperatura (pari a 25 ºC) e concentrazione (1 molare) delle soluzioni acquose. Quanto detto è reso graficamente nello schema qui sopra. Ma cosa succede se la semicella con l'elettrodo positivo di una pila non si trova in condizioni standard, ovvero se per esempio la concentrazione della sua soluzione non è 1 molare e la temperatura è di 90 ºC, anziché di 25 ºC?
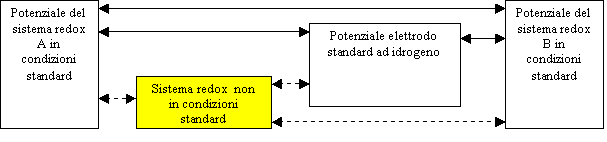
Evidentemente il confronto tra potenziali non è più possibile, visto che il potenziale standard di riduzione della semicella negativa non è omogeneo con quello non in condizioni standard rappresentativo dall'altra semicella. In altre parole, in presenza di una o di entrambe le semicelle non in condizioni standard nulla si può dire ricorrendo ai potenziali standard di riduzione su quale elettrodo sia il catodo e quale l'anodo e, conseguentemente, è impossibile calcolare la forza elettromotrice della pila. Qundi si deve trovare un modo per far sì che un sitema redox non in condizioni standard possa essere messo in relazione con i sistemi standard, ovvere rendere possibili (linea piena) i collegamenti al momento non leciti (linea tratteggiata) presenti nello schema qui sopra. E' molto importante risolvere questo problema dal momento che, a partire da una pila in condizioni standard, si ha inoltre che:
il valore della differenza di potenziale di una pila varia con la concentrazione degli ioni della o delle soluzioni. Di conseguenza è lo stesso decorso della reazione chimica che allontana le semicelle dalle condizioni standard;
una reazione chimica è notevolmente influenzata dalla natura del solvente e, visto che il potenziale assoluto d'elettrodo è una misura della forza di una specie a passare in soluzione, è evidente che esso cambia con il tipo di solvente impiegato. Per questo motivo nella notazione IUPAC della pile viene descritto il tipo di solvente della soluzione elettrolitica di ciascuna semicella;
la temperatura fa variare il potenziale assoluto d'elettrodo e ovviamente anche quello standard di riduzione. Ne segue che se non si è in condizioni standard a causa della temperatura, anche questo parametro va indicato quando si caratterizza lo stato chimico-fisico di un sistema.
L'equazione di Nernst (1889) consente di mettere in relazione il potenziale standard di riduzione Eº di una semicella con le condizioni in cui essa opera (diverse da quelle standard). In essa appaiono tutti i parametri influenzanti il potenziale precedentemente accennati. La differenza tra il potenziale standard di riduzione con quello che si ottiene dall'equazione di Nernst è in un certo senso la misura quantitativa del grado di allontanamento della semicella dalle condizioni standard. In altre parole, l'equazione di Nernst, modificando opportunamente il potenziale standard di riduzione di una semicella, permette di ripristinare l'omogeneità tra i potenziali e quindi di permetterne il reciproco confronto. Ne segue che per ogni pila non in condiziooni standard solo dopo aver modificato il potenziale standard di riduzione di ciascuna semicella è possibile dal confronto tra i potenziali di riduzione stabilire anodo e catodo della pila e la sua fem, pari a EC - EA.