
REGISTRO VISITATORI
| TA KIMIKA - esercizi risolti | |
|---|---|
 REGISTRO VISITATORI |
Esercizi |
| Titolazione acido-base | |
| Teoria - 1 - 2 - 3 - 4 | |
| Pagina dinamica di calcolo |
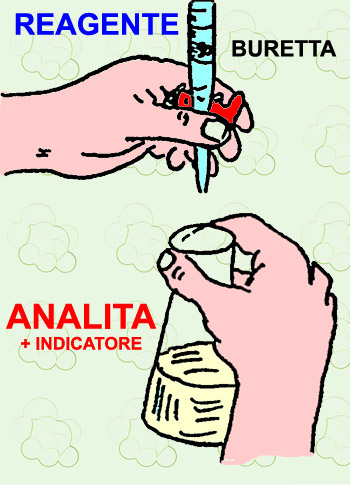 |
Nelle titolazioni volumetriche acido - base si aggiungono aliquote di reagente nell'analita fino al completamento della reazione chimica di neutralizzazione d'interesse, che in generale può scriversi come segue:
HA + BOH => BA + H2O
acido + base => sale + acqua
In una qualsiasi titolazione (acido-base, ossido-riduttiva) l'incognita è il titolo dell'analita ovvero della soluzione che si mette sotto la buretta e nella quale si versano aliquote di reagente a titolo noto.
Nelle titolazioni acido - base la procedura prevede, leggendo la buretta, l'ottenimento del volume di reagente in grado di neutralizzare l'analita. In assenza di uno strumento in grado di misurare il carattere acido o basico di una certa soluzione (pH-metro), si utilizzano delle sostanze, dette indicatori, che hanno la caratteristica di mutare colorazione in funzione dell'acidità della soluzione in cui esse vengono aggiunte. Ogni indicatore presenta un intervallo di pH in cui avviene il cambiamento di colore, detto viraggio. Per semplicità, si assuma negli esercizi che segueno che il viraggio degli indicatori utilizzati avvenga a pH = 7, ovvero in condizioni di perfetta neutralità.
Si osservi che nelle reazioni di neutralizzazione un acido HA ed una base BOH reagiscono tra loro dando come prodotti un sale BA ed eventualmente acqua. Il sale si trova facilmente se si tiene conto che:
- il numero di atomi di H nell'acido dice la valenza della parte restante. Ovvero in HNO3, NO3 ha valenza 1 in quanto è presente un solo atomo d'idrogeno. In H2SO4 è evidente che SO4 risulta essere bivalente (ci sono infatti 2 atomi di H);
- il numero di OH indica la valenza del metallo. In Ca(OH)2 la valenza del Ca è 2. In NaOH, la valenza del sodio Na è 1.
- nei sali si scrive prima il metallo e poi il resto mettendo dei pedici e inserendo entro parentesi gli eventuali gruppi a seconda della valenza dei singoli "pezzi" (ioni).
E' evidente che, per ottenere risultati attendibili, è della massima importanza la precisione con la quale viene preparata la soluzione acquosa del reagente. Infatti la soluzione da mettere nella buretta è una soluzione standard ovvero a titolo noto con alta precisione. La tecnica di preparazione di tali soluzioni dev'essere fatta con attenzione, altrimenti ciò che si ottiene non è significativo.
Lo schema logico che sta alla base di una titolazione è il seguente (fare clic sulle caselle in cui compare la manina per approfondire):

| Ultimo aggiornamento il 20-7-2023 | Quelli in verde sono link non ancora attivati. |
| Liceo Classico "Marco Foscarini" - Venezia | ||
|---|---|---|
| Museo di Fisica Traversi | Presentazione della scuola | Indirizzi, Numeri di telefono, E-Mail |