
REGISTRO VISITATORI
| Elettrochimica - Elettrochimica di base | |
|---|---|
 REGISTRO VISITATORI |
Nozioni d'elettrochimica |
| Elettrochimica di base | |
| Pile e celle elettrolitiche | |
| Precedente - Pagina - Successiva | |
| Galleria d'immagini |
|
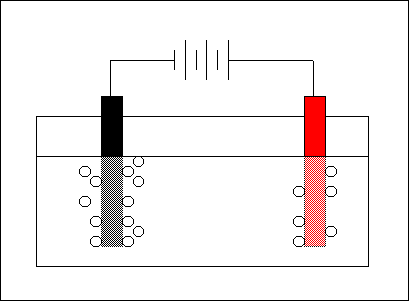
| Cella elettrolitica per l'elettrolisi dell'acqua Cella elettrolitica a NaCl fuso per ottenere Na e Cl2 |
Un qualsiasi processo elettrochimico è governato da una reazione di ossidoriduzione e il processo può essere spontaneo oppure non spontaneo. Di conseguenza anche i sistemi elettrochimici realizzabili possono sfruttare una redox spontanea o far avvenire in modo forzato (cioè spendendo energia) una redox oppure essere capaci di funzionare ora in un modo ora in un altro.
Pile
Le pile sono i sistemi elettrochimici che funzionano sfruttando una reazione redox spontanea; in esse viene convertita energia chimica in energia elettrica, che viene utilizzata per compiere lavoro. Le pile infatti erogano energia. Tutte le pile usa e getta funzionano in questo modo e sono tutte alla lontana "figlie" della prima pila della storia, la pila voltiana.
Celle elettrolitiche
Le celle elettrolitiche sono i sistemi elettrochimici nei quali far avvenire una reazione redox non spontanea; in esse viene convertita energia elettrica in energia chimica; in questi dispositivi dunque si spende energia.
Ad esempio, si può sfruttare una cella elettrolitica formata da due elettrodi (di carbone o di platino) per realizzare l'elettrolisi dell'acqua, cioè la separazione tramite corrente elettrica continua fornita al sistema dall'esterno tramite una pila del composto acqua nei sue due elementi costitutivi: idrogeno e ossigeno. L'idrogeno si sviluppa sulla superficie dell'elettrodo negativo (in nero in figura), mentre l'ossigeno sulla superficie di quello positivo (in rosso).
Sempre l'elettricità viene sfruttata, sotto forma di corrente continua, per ricavare sodio metallico e cloro a partire dal cloruro di sodio, il comune sale da cucina. Ciò si realizza in un'opportuna cella elettrolitica in cui è contenuto il sale fuso da sottoporre al processo di lisi. In corrispondenza dell'elettrodo negativo viene raccolto il metallo (in grigio in figura), mentre il cloro (bolle verdi) si sviluppa sull'elettrodo positivo.
Le applicazioni industriali dell'elettorlisi in opportune celle elettrolitiche comprendono processi quali l'elettrodeposizione (applicazione di una sottilissima pellicola ornamentale o protettiva sulla superficie di un metallo), la produzione di metalli puri, la raffinazione del rame, la sintesi dell'idrossido di sodio e dell'ipoclorito di sodio.
Accumulatori
Si tratta di sistemi elettrochimici nei quali una reazione redox viene fatta avvenire in un verso nel funzionamento come pila e nel verso opposto nella fase di carica. Tutte le batterie ricaricabili di ogni tipo sono degli accumulatori.
| Ultimo aggiornamento il 20-7-2023 | Quelli in verde sono link non ancora attivati. |
| Liceo Classico "Marco Foscarini" - Venezia | ||
|---|---|---|
| Museo di Fisica Traversi | Presentazione della scuola | Indirizzi, Numeri di telefono, E-Mail |