
REGISTRO VISITATORI
| Elettrochimica - Elettrochimica di base | |
|---|---|
 REGISTRO VISITATORI |
Nozioni d'elettrochimica |
| Elettrochimica di base | |
| L'elettrodo normale a idrogeno | |
| Precedente - Pagina - Successiva | |
Un sistema costituito da due semicelle opportunamente collegate in cui far avvenire una reazione di ossidoriduzione spontanea è noto come pila. Si immagini di avere due semicille ciascuna costituita da una lamina di metallo immersa in una soluzione contenente cationi del metallo stesso. Per esprimere quantitativamente la tendenza di un metallo a passare in soluzione, cioè il suo potenziale assoluto d'elettrodo, è necessario trovare un metodo per misurarlo.
Per far ciò osserviamo per prima cosa che la differenza di potenziale ai capi delle due lamine di metallo, una per semicella, che costituiscono una semplice pila, si ottiene facilmente in via di principio per semplice differenza tra i potenziali assoluti d'elettrodo. In altre parole, in una pila formata da una semicella con il rame di potenziale assoluto d'elettrodo Y e da un'altra con lo zinco con potenziale assoluto pari a X, la differenza di potenziale della pila è semplicemente Y - X. Da ciò si ricava poi che in via del tutto generale conoscendo in qualche modo i valori X e Y per una qualsiasi semireazione, si potrebbe calcolare facilmente la differenza di potenziale tra gli elettrodi della pila che sfrutta le due semireazioni scelte.
Purtroppo le cose non sono così semplici, dal momento che è difficilissimo calcolare il valore del potenziale assoluto d'elettrodo di un semicella. Inoltre per via sperimentale la sua misura richiederebbe obbligatoriamente un secondo elettrodo direttamente o indirettamente a contatto con la soluzione della semicella. Ciò comporta la formazione di un altro micro condensatore a livello del secondo elettrodo e di fatto alla formazione di una pila completa. Insomma in questo modo ciò che si misurerebbe sarebbe sempre una differenza di potenziale tra due metalli, ovvero di una pila, e non quella solo della semicella in esame. Si deve poi considerare che il potenziale assoluto d'elettrodo varia con la concentrazione della soluzione elettrolitica e anche con la temperatura.
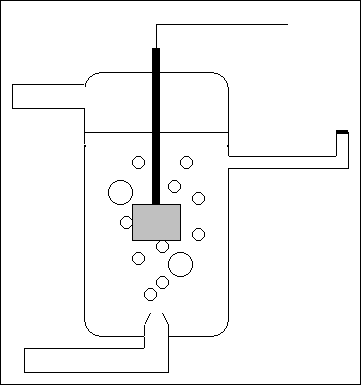
Visto che è impossibile eliminare il secondo elettrodo per eseguirte la misura, è stato allora introdotto l'elettrodo normale a idrogeno, cioè un particolare elettrodo di riferimento. Di questo elettrodo, meglio semicella, sono state rigorosamente definite le condizioni da realizzare per ottenere il valore convenzionale nullo del suo potenziale. Esso è formato da un elettrodo di platino platinato (in grigio), immerso in una soluzione acquosa acida 1 molare nella quale viene fatto gorgogliare idrogeno gassoso puro, mantenuto alla pressione di una atmosfera. Il platino, oltre a servire come conduttore attraverso cui gli elettroni possono entrare ed uscire dall'elettrodo, agisce anche come catalizzatore ed essendo poroso, in seguito al trattamento elettrochimico eseguito sulla sua superficie, le molecole di idrogeno vengono adsorbite e costituiscono l'elettrodo vero e proprio. Sempre per convenzione all'elettrodo standard ad idrogeno viene assegnato potenziale nullo a tutte le temperature.
In queste condizioni, l'equilibrio elettrochimico che si instaura abbastanza rapidamente è espresso dalla reazione d'ossidoriduzione semplificata
2H+ + 2e- <=> H2.
Per la verità, dal momento che il tutto avviene in soluzione acquosa e che nella realtà un protone (H+) non può partecipare così come sta ad una reazione chimica per questioni energetiche, la reazione corretta sarebbe
2H3O+ + 2e- <=> H2 + 2H2O.
| Ultimo aggiornamento il 20-7-2023 | Quelli in verde sono link non ancora attivati. |
| Liceo Classico "Marco Foscarini" - Venezia | ||
|---|---|---|
| Museo di Fisica Traversi | Presentazione della scuola | Indirizzi, Numeri di telefono, E-Mail |