
| Elettrochimica - Elettrochimica di base | |
|---|---|

|
Nozioni d'elettrochimica |
| Elettrochimica di base | |
| La scala dei potenziali standard di riduzione | |
| Precedente - Pagina - Successiva | |
| Galleria d'immagini |
|
| Pila standard per ottenere EºZn Pila standard per ottenere EºCu |
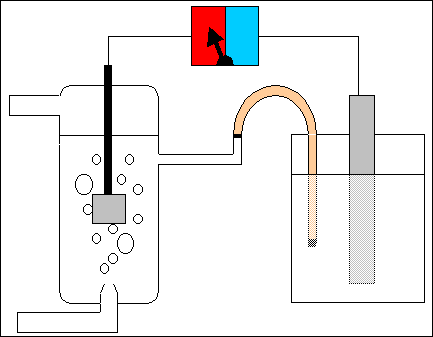
Avendo assunto per convenzione valore nullo del potenziale assoluto d'elettrodo per l'elettrodo normale ad idrogeno, è allora evidente che in questo caso, quando si uniscono due semicelle, delle quali una è costituita dal particolare elettrodo di riferimento, la differenza di potenziale E della pila così formata misura direttamente il valore incognito del potenziale d'elettrodo dell'altra semicella, essendo E = Y - X, con ad esempio X = 0, perchè relativo all'elettrodo a idrogeno.
In altre parole, scelto l'elettrodo di riferimento, si può costruire sperimentalmente una scala relativa dei potenziali standard. Affinché i valori di potenziale ottenuti con questo metodo siano coerenti tra di loro, tutte le semicelle che si uniscono con quella normale a idrogeno devono essere in condizioni standard, cioè alla temperatura di 25 ºC e con soluzioni a concentrazione ionica 1 molare. Ciò che così si ottiene sono per ogni semicella il potenziale normale standard e, mettendoli in ordine crescente o decrescente, la serie elettrochimica dei potenziali standard. Vediamo con due semplici esempi come si ottengono i potenziali standard, indicati con Eº, della semicella con lo zinco e di quella con il rame.
Per determinare il potenziale standard della semicella formata da una lamina di zinco in una soluzione 1 molare di ioni zinco Zn++, si costruisce la pila a ponte salino in figura, ovvero una pila con un elettrodo di zinco e un altro costituito dall'elettrodo nomale ad idrogeno. L'indicatore del voltmetro a zero centrale (lo strumento che misura la differenza di potenziale in valore e segno) si sposta ad esempio verso sinistra (zona rossa). Lo strumento misura il valore di 0,763 V. Questo è anche il valore del potenziale assoluto (standard) d'elettrodo EºZn della semicella con lo zinco, essendo nullo il potenziale dell'elettrodo normale a idrogeno.
Per determinare il potenziale standard della semicella formata da una lamina di rame in una soluzione 1 molare di ioni rame Cu++, si costruisce una pila simile a quella precedente (vedi figura), ovvero una pila con un elettrodo di rame e un altro costituito dall'elettrodo nomale a idrogeno. L'indicatore del voltmetro a zero centrale si sposta questa volta a destra (zona azzurra). Lo strumento misura il valore di 0,337 V. Questo è anche il valore del potenziale assoluto (standard) d'elettrodo EºCu della semicella con il rame.
| Sistema | Eº [V] | Sistema | Eº [V] | Sistema | Eº [V] |
|---|---|---|---|---|---|
| Li+/Li | -3,05 | Fe++/Fe | -0,44 | Pd++/Pd | +0,99 |
| Na+/Na | -2,71 | 2H+ / H2 | 0,000 | Pt++/Pt | +1,19 |
| Al+++/Al | -1,66 | Cu++/Cu | +0,34 | Cl2/2Cl- | +1,36 |
| Cr++/Cr | -0,91 | I2/2I- | +0,53 | Au+++/Au | +1,50 |
| Zn++/Zn | -0,76 | Ag+/Ag | +0,80 | F2/2F- | +2,87 |
La procedura appena illustrata si può estendere a qualsiasi semicella purché essa sia in condizioni standard. L'indicatore del voltmetro, oltre a dare un valore della differenza di potenzale, si sporterà a volte a destra e a volte a sinistra. Assumendo come negativi i valori dei potenziali standard quando l'ago del voltmetro è nella parte rossa (comportamento simile allo zinco) e come positivi quando l'ago è nella zona azzurra (comportamento simile al rame), tali potenziali si possono ordinare ottenendo la serie elettrochimica dei potenziali (vedi tabella qui a lato). Questa serie di potenziali costituisce in un certo senso la "tavola periodica dell'elettrochimica", poiché da essa si possono ricavare un gran numero di informazioni riguardanti sia le pile che le celle elettrolitiche.